Comparte en:
¿Que es la ebullición?
Empecemos diciendo que la materia se nos presenta en forma de tres estados de agregación: sólido, líquido y gaseoso.
Los tres estados difieren en la fuerza con la que se unen las moléculas. Las moléculas son grupos de átomos que constituyen e identifican una sustancia. Por ejemplo, la molécula de agua es H2O (dos átomos de hidrógeno y uno de oxígeno unidos) y las moléculas de agua a su vez interactúan más o menos fuertemente en los tres diferentes estados de agregación: sólido (hielo), líquido y gas (vapor de agua).

En el estado sólido, las moléculas están fuertemente unidas, en el líquido un poco menos y en los gases casi no hay ningún tipo de interacción.
El agua líquida se convertirá en vapor cuando la temperatura aumente, provocando la ruptura total de cualquier enlace intermolecular y la liberación de todas las moléculas de cualquier organización rígida. Por tanto, cuando ponemos agua al fuego, lo que hacemos es provocar una aceleración del movimiento de las moléculas del agua.
La ebullición es un proceso físico en el que un líquido pasa al estado gaseoso. La temperatura a la cual ocurre es diferente para cada sustancia. Esta temperatura puede variar según la presión atmosférica.
Diferencia entre evaporación y ebullición
Es bueno en este punto distinguir el concepto de evaporación del de ebullición.
Si dejamos un vaso de agua en la mesita de noche durante un tiempo determinado, notaremos que el nivel del agua disminuye. De la misma manera, los charcos en la calle desaparecen lentamente y los calcetines mojados se secan al paso de unas horas. Lo que ocurre es el proceso de evaporación, es decir, el paso de moléculas de agua líquida al estado gaseoso a temperatura ambiente, inferior a la temperatura de ebullición.
Al calentar el agua sobre el fuego, aumentamos su temperatura, es decir, suministramos cada vez más energía a las moléculas de agua para que el número de las que pasan al estado de vapor aumente constantemente hasta llegar a un punto de ebullición, que para el agua pura es de 100 °C.
Por lo tanto, tanto en la evaporación como en la ebullición se produce la vaporización (transición de estado líquido a vapor), pero mientras que en el primer caso el proceso es lento y afecta solo a las moléculas de la superficie del líquido, en el segundo caso todas las moléculas están involucradas.

En resumen, las principales diferencias entre la evaporación y la ebullición son:
- La evaporación ocurre de forma lenta y gradual. La ebullición ocurre de forma más rápida y es bien perceptible.
- La evaporación ocurre a cualquier temperatura. En la ebullición ocurre a una temperatura determinada.
- La evaporación ocurre en la superficie del líquido. La ebullición ocurre en toda la extensión del líquido.
- El signo principal de la ebullición es la agitación y formación de burbujas, signo que no se presenta en la evaporación.
La presión atmosférica
En este punto hay que señalar que la presión atmosférica también juega un efecto en este proceso. En pocas palabras, la presión es el peso del aire. El aire es una mezcla de gases y su peso es por tanto el de las moléculas de los gases que lo componen, especialmente el nitrógeno y el oxígeno.
La presión puede también expresarse en «atmósfera», la cual equivale a la presión que ejerce la atmósfera terrestre al nivel del mar. Esta unidad suele abreviarse como «atm». Y 1 atmósfera equivale a 101.3 kilopascal.
El punto de ebullición normal del agua es de 100°C, lo que ocurre cuando la presión atmosférica es exactamente de 1 atm. Si la presión atmosférica es inferior a 1 atm, el punto de ebullición del líquido disminuirá, como es el caso en altitudes más altas de la Tierra.
La evaporación o ebullición no tiene lugar en el vacío: las moléculas que "escapan" del líquido y pasan al estado gaseoso encuentran por encima de ellas las moléculas que componen el aire que de alguna manera dificultan este proceso al "empujarlas de vuelta hacia atrás", es decir, hacia el líquido.
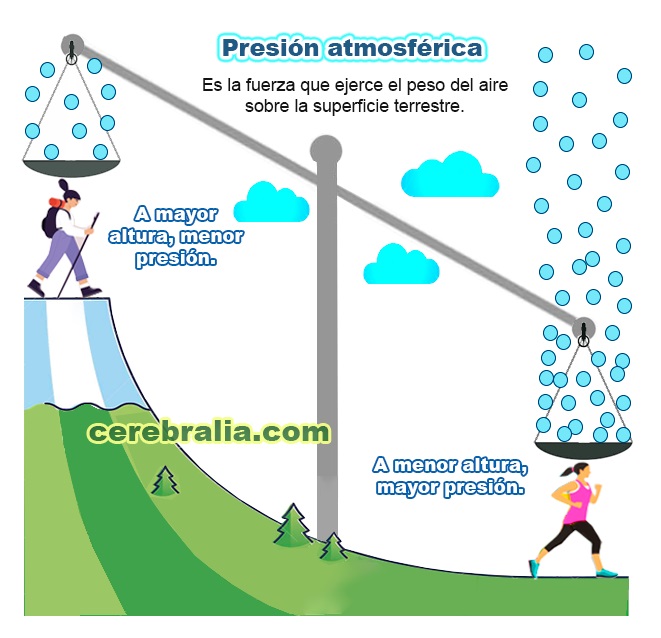
Subiendo de altura, la presión atmosférica disminuye, es decir, por encima de nuestras cabezas hay menos aire, similar a lo que sucede al pasar bajo el agua, cuanto más bajamos, más agua hay por encima de nosotros y más aumenta la presión.
Por cierto, menos aire también significa menos oxígeno y es por eso que en las montañas nos quedamos más fácilmente sin aliento. Así, si ponemos agua a hervir en las montañas, las moléculas de agua que quieran ir al estado gaseoso encontrarán menos moléculas de aire por encima de ellas, y la vaporización será más fácil.
| Lugar | Presión atmosférica | Punto de ebullición del agua |
|---|---|---|
| Al nivel del mar | 101.3 kPa | 100 °C |
| En la cima del Monte Everest | 33.7 kPa | 70 °C |
| En Marte (promedio) | 0.6 kPa | 10 °C |
| En Venus (promedio) | 9200 kPa | 300 °C |
Lo contrario sucede en una olla a presión donde el vapor que se libera a medida que el agua se evapora, permaneciendo cerrada dentro de la olla, crea una presión por encima del líquido más alta de lo normal. En consecuencia, será más difícil para las moléculas de agua líquida cambiar al estado de vapor y el agua hervirá a temperaturas superiores a 100 °C. Esto hace que los alimentos se cocinen a una temperatura más alta y, por lo tanto, más rápido.

