Compartilhe
O que é a ebulição?
Comecemos dizendo que a matéria vem na forma de três estados de agregação: sólido, líquido e gasoso.
Os três estados diferem na força com que as moléculas estão ligadas entre si. As moléculas são grupos de átomos que compõem e identificam uma substância. Por exemplo, a molécula de água é H2O (dois átomos de hidrogênio e um de oxigênio ligados entre si) e as moléculas de água, por sua vez, interagem mais ou menos fortemente nos três diferentes estados de agregação: sólido (gelo), líquido e gás (vapor de água).

No estado sólido, as moléculas estão fortemente unidas, nos líquidos um pouco menos, e nos gases quase não há interação alguma.
A água líquida se transformará em vapor à medida que a temperatura subir, causando a ruptura completa de quaisquer ligações intermoleculares e a liberação de todas as moléculas de qualquer organização rígida. Portanto, quando colocamos água no fogo, o que fazemos é provocar uma aceleração do movimento das moléculas de água.
A ebulição é um processo físico no qual um líquido muda para um estado gasoso. A temperatura em que ocorre a ebulição é diferente para cada substância. Esta temperatura pode variar de acordo com a pressão atmosférica.
Diferença entre evaporação e ebulição
É bom neste ponto distinguir o conceito de evaporação do conceito de ebulição.
Se deixarmos um copo d'água na mesinha de cabeceira por um certo tempo, notaremos que o nível da água diminui. Da mesma forma, as poças na rua desaparecem lentamente e as meias molhadas secam depois de algumas horas. O que ocorre é o processo de evaporação, ou seja, a passagem das moléculas de água líquida para o estado gasoso à temperatura ambiente, abaixo da temperatura de ebulição.
Ao aquecer a água sobre um incêndio, aumentamos sua temperatura, ou seja, fornecemos cada vez mais energia às moléculas de água para que o número de moléculas que passam para o estado de vapor aumente constantemente até atingirmos um ponto de ebulição, que é 100 °C para água pura.
Assim, tanto na evaporação quanto na ebulição, ocorre a vaporização (transição do estado líquido para o estado de vapor), mas enquanto no primeiro caso o processo é lento e afeta apenas as moléculas na superfície do líquido, no segundo caso todas as moléculas estão envolvidas.

Em resumo, as principais diferenças entre evaporação e ebulição são as seguintes:
- A evaporação ocorre lenta e gradualmente. A ebulição ocorre mais rapidamente e é bem perceptível.
- A evaporação ocorre a qualquer temperatura. A ebulição ocorre a uma determinada temperatura.
- A evaporação ocorre na superfície do líquido. A ebulição ocorre em todo o líquido.
- O principal sinal de ebulição é a agitação e a formação de bolhas, que não está presente na evaporação.
O que é pressão atmosférica?
Neste ponto, deve-se notar que a pressão atmosférica também desempenha um papel neste processo. Simplificando, a pressão é o peso do ar. O ar é uma mistura de gases e seu peso é, portanto, o peso das moléculas de seus gases constituintes, especialmente nitrogênio e oxigênio.
A pressão também pode ser expressa em «atmosfera» que é equivalente à pressão exercida pela atmosfera terrestre ao nível do mar. Esta unidade é freqüentemente abreviada como «atm». E 1 atmosfera é equivalente a 101,3 quilopascal (kPa).
O ponto normal de ebulição da água é 100°C, o que ocorre quando a pressão atmosférica é exatamente 1 atm. Se a pressão atmosférica for inferior a 1 atm, o ponto de ebulição do líquido diminuirá, como é o caso em altitudes mais elevadas na Terra.
A evaporação ou ebulição não ocorre no vácuo: as moléculas que escapam do líquido para o estado gasoso encontram acima delas as moléculas que compõem o ar, o que de alguma forma dificulta este processo empurrando-as para trás, ou seja, para dentro do líquido.
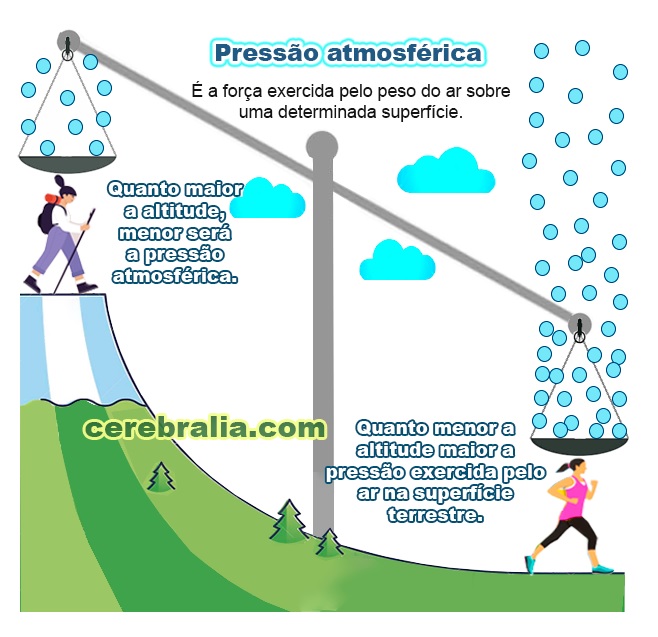
À medida que vamos subindo, a pressão atmosférica diminui, ou seja, há menos ar acima de nossas cabeças, semelhante ao que acontece quando vamos para debaixo d'água, quanto mais baixo vamos, mais água há acima de nós e mais a pressão aumenta.
A propósito, menos ar também significa menos oxigênio, e é por isso que estamos mais facilmente sem fôlego nas montanhas. Assim, se fervermos água nas montanhas, as moléculas de água que querem ir para o estado gasoso encontrarão menos moléculas de ar acima delas, e a vaporização será mais fácil.
| Localidade | Pressão atmosférica | Ponto de ebulição da água |
|---|---|---|
| Ao nível do mar | 101.3 kPa | 100 °C |
| No cume do Monte Everest | 33.7 kPa | 70 °C |
| Em Marte (média) | 0.6 kPa | 10 °C |
| Em Vênus (média) | 9200 kPa | 300 °C |
O oposto acontece em uma panela de pressão onde o vapor que é liberado à medida que a água evapora, permanecendo fechado dentro da panela, cria uma pressão maior do que a normal acima do líquido. Consequentemente, será mais difícil para as moléculas de água líquida mudarem para o estado de vapor e a água ferverá a temperaturas acima de 100 °C. Isto faz com que o alimento cozinhe a uma temperatura mais alta e, portanto, mais rápido.

